Lidské zdraví významně ovlivňují i střevní mikroorganismy. Vědci se tak snaží zjistit, jak tato společenství bakterií vznikají a jaké mají dopady na fungování lidského organismu. V tom jim pomáhá i nový typ myši GM15.
 S novinkou teď přišli vědci z Mikrobiologického ústavu [MÚ] AV ČR, francouzského Ústavu funkční genomiky a francouzského Technologického výzkumného ústavu BioAster. Ti vyvinuli speciální laboratorní myší model na kontrolu střevních bakterií. Výsledky jejich práce již publikoval prestižní časopis Nature Communications.
S novinkou teď přišli vědci z Mikrobiologického ústavu [MÚ] AV ČR, francouzského Ústavu funkční genomiky a francouzského Technologického výzkumného ústavu BioAster. Ti vyvinuli speciální laboratorní myší model na kontrolu střevních bakterií. Výsledky jejich práce již publikoval prestižní časopis Nature Communications.
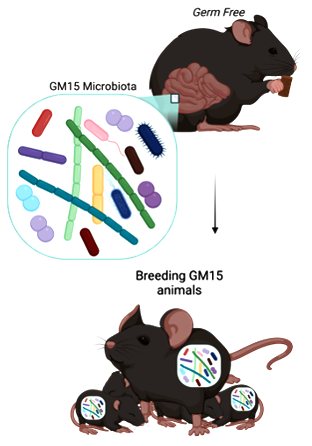
Nový myší model nazvaný „GnotoMice15“ [GM15] vědci vyvinuli pro účely dalšího výzkumu. Jejich myši umožňují předklinické studie zaměřené na zkoumání základních mechanismů a souvislostí mezi biologií střevních mikroorganismů a její interakcí s hostitelem. Podstata věci zjednodušeně spočívá v možnosti implantovat do původně bezmikrobní myši mikrobiom, který je zároveň přenosný na její potomstvo.
„V praxi by to mohlo znamenat, že laboratoř například v Anglii a laboratoř v České republice si objednají myší linii, která bude standardizovaná jak geneticky, tak i z hlediska mikrobiomu. V konečném důsledku by to vedlo k lepší reprodukovatelnosti výsledků mezi laboratořemi a také k menšímu množství použitých zvířat,“ vysvětluje, o co jde, Martin Schwarzer z MÚ AV ČR, jehož výzkumný tým se na publikaci podílel.
O „svých“ myších vědí vědci vše
GM15 představuje nový typ laboratorní myši s miniaturní umělou střevní mikrobiotou. Ta se skládá z 15 bakteriálních kmenů izolovaných ze střeva běžné laboratorní myši. Tyto kmeny lze kultivovat a sledovat. Zároveň reprezentují sedm z 20 dominantních bakteriálních rodin myších střevních mikroorganismů. Mají i plně rozluštěný genom i podrobně popsané funkce, které jsou v něm zakódovány. Vědci tak mohou pozorovat přenos na potomstvo, a především detailně kontrolovat a manipulovat se složením střevních bakterií.
„Použitá mikrobiota je odolná i vůči malým změnám ve výživě myší souvisejících s různými chovatelskými postupy. Navzdory své jednoduchosti navíc dokáže nahradit i funkce složitějších střevních bakterií tím, že účinně obnovuje celou řadu biologických procesů, které jsou u jedinců bez střevní mikrobioty narušeny,“ upozorňuje Schwarzer.
Podle něj je nový model myší navíc schopen účinného přenosu mezi různými pokusnými chovy. Vědci přenesou danou mikrobiotu do původně bezmikrobního zvířete, kde ta se usadí a trvale přebývá. Je tak přenositelná na potomstvo a obnovuje mnoho vývojových, metabolických, endokrinních a imunitních funkcí, které souvisejí s činností střevních mikroorganismů. Což je unikátní už proto, že myší mikrobiota je složena z pouhých 15 bakteriálních kmenů.
Naopak mikrobiální společenství obývající lidská střeva tvoří v přirozeném stavu stovky bakteriálních kmenů a dalších mikroorganismů. Ty mezi sebou a svým hostitelem navazují četné interakce. Jsou nezbytné pro správné nastavení mikrobiálního ekosystému a formují a podporují správný vývoj a efektivní fungování organismu a tím přispívají k jeho zdraví.
„Každý jedinec hostí ve svém střevě unikátní komplexní směs bakterií. Vědci ji dokážou pomocí sekvenování rozklíčovat a případné změny v zastoupení bakterií spojit se změnami ve fungování organismu nebo s rozvojem nemocí. Studie jsou ale často jen popisné a nedokážou odhalit samotný dopad bakterií na chod organismu,“ říká jedna ze spoluautorek publikace Tereza Novotná z MÚ AV ČR.
Podle ní přitom platí, že díky tomu, že vědci mají popsaný genom daných bakterií, dokáží určit funkci jednotlivých bakterií i v modelech lidských onemocnění. A tak i pochopit, jak střevní bakterie ovlivňují fungování hostitelského organismu.
V čem spočívá výhoda myší GM15
Vědci vytvořená a definovaná mikrobiota u myší GM15 napodobuje fungování komplexních střevních mikroorganismů u lidí. Její výhoda pak spočívá i v tom, že umožňuje sledovat jednoduše změny v počtech jednotlivých bakterií přímo v laboratoři.
„Máme k dispozici hromadu různých dílků [jednotlivé střevní bakterie] a z nich vybíráme a skládáme dohromady model [střevní mikrobiom]. O každém dílku přitom víme, co je zač, protože se jedná o sekvenované bakterie. Když je přidáme do modelu, vidíme, jak funguje s ostatními kostičkami, tedy jestli je důležitý pro nějakou výslednou funkci, nebo naopak není,“ přibližuje výhody nové metody Martin Schwarzer.
Dodává, že nový myší model jim umožňuje i skládat mikrobiotu z různých bakterií. Přidávat nebo ubírat jednotlivé bakterie a přitom sledovat, jak výsledný model na hostitele působí. Podle něj právě tato modularita otevírá úžasné možnosti, které přispějí k porozumění, jak střevní bakterie fungují mezi sebou navzájem. A jakým způsobem ovlivňují hostitele.
–DNA–