Nejméně v 16 italských nemocnicích se podává pacientům s rakovinou nekvalitní lék, který není schválen k použití v zemích Evropské unie. Dovoz léků je ale legální. Na situaci v italských nemocnicích upozorňuje bruselský list Politico.
Mezera v národní a unijní lékové regulaci umožnila italským nemocnicím legálně dovážet lék Celginase. Používá se k léčbě lymfoblastické dětské leukémie, nejčastější formy rakoviny u dětí. Lék do Itálie proudí z Indie, kde se i vyrábí. Neví se ale, kolik pacientů s rakovinou se s jeho účinky seznámilo. Mnoho dávek léku je stále ještě v nemocnicích.
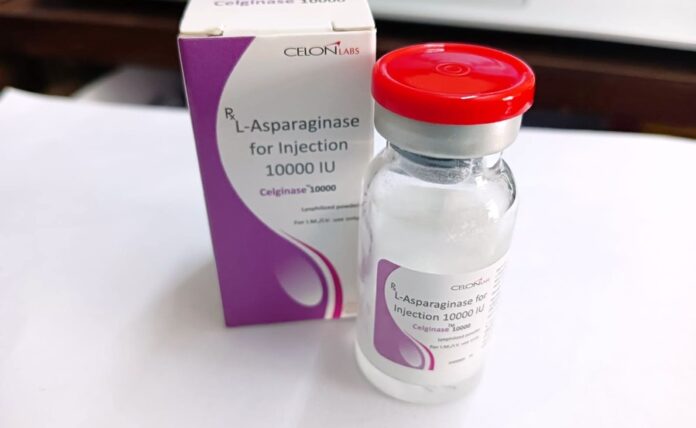
Celginase využívá účinnou látku asparaginázu. Vyrábí se a je schválený v Indii a jeho cena je pouhým zlomkem ceny plnohodnotného léku. Lahvička stojí 13 eur [cca 314 Kč] ve srovnání s 2 500 eury [cca 60 400 Kč] za schválený lék. Publikované studie uvádějí, že lék nesplňuje ani minimální výrobní standardy a nesplňuje ani klinické nároky na léčbu rakoviny.
Avšak ani italský lékový regulátor, ani italské ministerstvo zdravotnictví nejsou povinny prověřovat kvalitu, účinnost a bezpečnost tohoto léku dříve, než povolí jeho dovoz. A nepřísluší to ani Evropské agentuře pro léčivé přípravky [EMA].
Kancelář investigativní žurnalistiky [TBIJ], z jejichž závěrů Politico vychází, a American health news site [lék je v nabídce i v USA, pozn. red.] zjistily, že indické léky s účinnou látkou asparagináza, včetně Celginase, se od roku 2016 vyvezly do více než 90 zemí a ohrozily životy a zdraví asi 70 000 dětí na celém světě.
Lék Celginase: Co zjistilo nezávislé pátrání
Většina léků Celginase dovezená do Itálie pochází z Indie a do země přišla přes Švýcarsko. Švýcarské celní orgány sdělily, že nemají k dispozici údaje o těchto lécích. Nemají ani ponětí o tom, zda indický lék dovezený přes Švýcarsko skončil i v jiné zemi než v Itálii. Avšak v žádném případě ve Švýcarsku.
Podle zákona o svobodném přístupu k informacím od italské celní agentury ministerstva zdravotnictví TBIJ i Politico zjistily, že nejméně 16 nemocnic, včetně milánského Istituto Nazionale Tumori a římské nemocnice San Camillo Forlanini, dovezlo za uplynulých sedm let stovky dávek Celginase.
Istituto Nazionale Tumori uvedl, že ho k používání Celginase přiměl nedostatek léků. A dodal, že pacienti, kteří lék obdrželi, měli buď pozitivní odezvu, nebo odeznění příznaků. Odvolal se i na to, že italský lékový administrátor nikdy nezveřejnil informace, že by měl být Celginase škodlivý. Nemocnice San Camillo Forlanini na dotazy neodpověděla.
Attilio Guarini, lékař léčící pacienty s akutní lymfoblastickou leukémií v nemocnici Policlinico di Bari, uvedl, že neexistuje žádný klinický manuál, který by doporučoval lékařům návrat k původním Asparaginase, jako je Celginase. Samozřejmě, pokud je k dispozici lék Oncaspar.
Italský lékový regulátor sdělil, že nenese žádnou odpovědnost za „účinnost a bezpečnost“ léků dovážených z neunijních zemí. A to ani těch léků, které neschválili unijní regulátoři. A jak uvedl její bývalý šéf Guido Rasi, EMA není schopna dozorovat dovoz neschválených léků z neunijních zemí.
Výpadky léků v Itálii
Celostátní nedostatek léku Oncasparu, který je považovaný za „zlatý standard“ skupiny Asparagináza, v roce 2018 vedl k tomu, že Itálie nakupovala jiný lék, a sice Aspatero. Ten později autority ale označily jako nestandardní. Dotčené nemocnice avšak uvedly, že jejich žádost o dovoz léku Aspatero schválil italský lékový regulátor. Upozornily, že bez těchto léků by se „snížila šance dětí na uzdravení.“ Regulátor svůj souhlas potvrdil.
Podle listu Politico se Celginase v Itálii ale používal dokonce i v době, kdy byl k dispozici lék ze „zlatého standardu.“ V některých případech ještě nedávno. Další záznamy ukazují, že se Celginase dovážel do sedmi italských nemocnic. Skutečný počet zařízení, která ho pacientům podávala, ale může být mnohem vyšší.
I když oba léky, Celginase a Oncaspar, jsou ze skupiny Asparagináze, jsou v nich i rozdíly: Celginase je původní a Oncaspar modifikovaný. Oncaspar byl schválený pro použití v Evropě v roce 2016 a je to druh Asparagináze doporučený jako první volba léčby akutní lymfoblastické dětské leukémie.
Existuje i několik různých typů léku Asparagináze. Původní se vyrábí z Escherichia coli [E.coli]. Přeměna této bakterie v lék je velmi složitá. Dokonce i kvalitní Asparagináza má nežádoucí vedlejší účinky, včetně vážných alergických reakcí. Z tohoto důvodu lékaři dávají přednost používání jeho modifikované verze. Má mírnější vedlejší účinky, ale je mnohem dražší.
Když v Itálii chybí potřebný lék
Pokud je v Itálii lék nedostatkový, lékaři a farmaceuti mohou požádat lékového regulátora, aby povolil dovoz totožného léku z jiné země. Jiný zákon povoluje lék, který sice není schválen v EU, ale jinde ve světě ano. To je případ Celginasu. Může být dovezený pro určitého pacienta, pokud se lékař domnívá, že není k dispozici jeho alternativa. Také ale platí, že lékaři mohou požádat o dovoz Celginase, i když mají Oncaspar k dispozici. Tento postup podle Politico ale zásadně obchází národního regulátora.
„V Itálii místo něj dovoz povoluje celní agentura ministerstva zdravotnictví. To však dohlíží jen na to, že jsou dokumenty nemocnicí řádně vyplněny a že lék, který přišel, je skutečně ten, který si nemocnice vyžádala,“ uvádí list.
Podle zákona agentura nemusí testovat kvalitu dovezeného léku. A nemusí ani zjišťovat údaje od zahraničního regulátora, který ho schválil. Odpovědnost za použití léku tedy leží jen na lékaři, který si ho vyžádal.
Italská léková agentura se v této věci omezila jen na to, že by lékaři měli používat spolehlivé dodavatele. To takové, kteří zaručí kvalitu a bezpečnost léku. Což platí hlavně u dodavatelů z neunijních zemí. Lékaři by měli mít od pacienta i kvalifikovaný souhlas.
Unijní pravidla pro užití neschválených léků
V roce 2001 EU zveřejnila novou legislativu, která povoluje léky, které „kryjí speciální potřebu“ a mohou být vyňaty ze standardních unijních pravidel ohledně kvality, bezpečnosti, účinnosti a výroby. To však jen za přísných podmínek.
Každý z těchto léků [i ty, které nejsou v rámci EU schváleny, pozn. red.] musí být vyvinut podle specifikace pověřených lékařských profesionálů nebo farmaceutů a podávaný danému pacientovi na osobní odpovědnost lékaře.
Každá země má tuto podmínku v národním právním systému, ale uplatňuje jinou praxi. V Itálii musí lékař odůvodnit výjimečné použití léku, což ověřuje celní agentura ministerstva zdravotnictví. Ve Španělsku nemocnice obdrží od regulátora povolení k použití neschváleného léku. V Irsku zase lékař vydá recept a velkoobchod či výrobce musí dovoz regulátorovi oznámit.
Léky musí za pacientem, ne za lékárnou, říká náměstek ministra
Zatímco v rámci unijního zákona by měl být lék poskytován jen jednotlivým pacientům, v praxi tomu tak není. Například v Německu a Itálii je povolování objednávek dostatečně benevolentní, aby si nemocniční lékárny mohly udělat zásoby. V Irsku byl zákon vykládán tak volně, že v jeho rámci výrobci dovezli přes 1,5 milionu balení 50 nejpopulárnějších léků.
„Paradoxní je, že zatímco evropští lékaři jsou jednou z nejregulovanějších profesí na světě, léky, které přicházejí ze zahraničí, mnohdy nesplňují ani minimální standardy,“ píše Politico.
Podle listu plánovaná revize unijního farmaceutického zákona by měla zahrnout ujednání, že země „budou požadovat,“ aby lékaři a pacienti nahlašovali údaje o bezpečnosti nelicencovaných léků domácímu regulátorovi.
Michal Achremenko