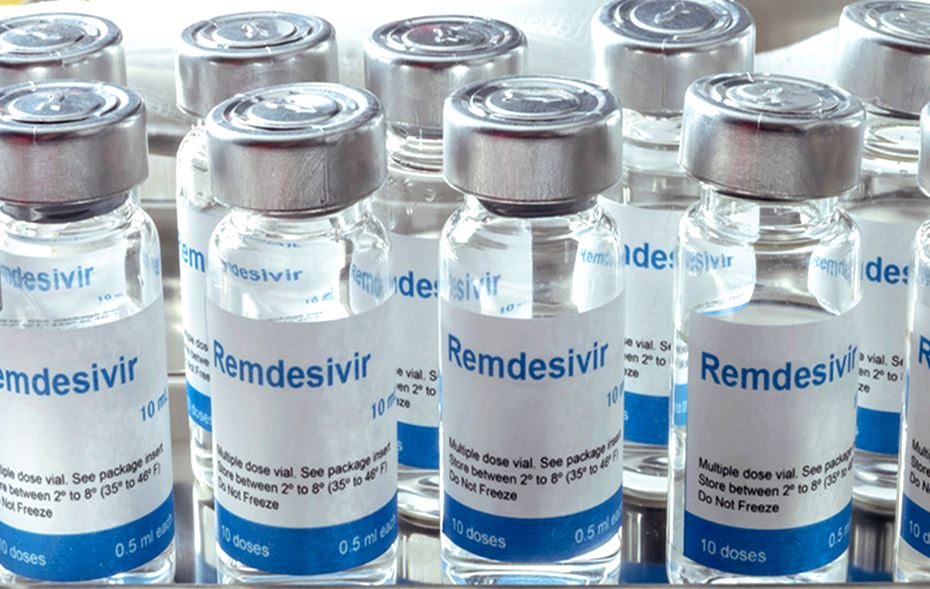
Světová zdravotnická organizace [WHO] nedoporučuje k léčbě covidu přípravek remdesivir. Podle ní chybějí jakékoliv důkazy o tom, že americký lék zvyšuje šance na přežití lidí s covidem. V Evropě se remdesivirem léčí tisíce pacientů.
Skupina mezinárodních expertů sdružená v rámci WHO opakovaně prohlásila, že léčivý přípravek od americké farmaceutické firmy remdesivir původně vyvinutý k léčbě krvácivé horečky ebola, není doporučeníhodný pro hospitalizované pacienty s nemocí covid-19. A to bez ohledu na to, jak vážný jejich zdravotní stav je.
Doporučení expertní skupiny vychází podle WHO z nových výsledků výzkumu o remdesiviru. V něm odborníci porovnávali účinky několika medikamentů používaných při léčbě covidu-19 na 7 tisících osob v hospitalizaci. Je však nutné zmínit, že z výsledků nevyplývá, že americký remdesivir nemá na léčbu žádný efekt, ale spíše to, že nejsou jasné důkazy o zlepšení zdravotního stavu pacientů po jeho podávání.
Své negativní stanovisko k užívání remdesiviru na léčbu covidu-19 zdůvodnila WHO i možností škodlivých vedlejších účinků. Upozornila na relativně vysokou cenu léku i jeho nesnadnou aplikaci [remdesivir musí být vpichován do žíly, pozn. red.]. Naopak firma Gilead svůj lék brání a dokládá studie o jeho prospěšnosti.
Americký remdesivir je jediný lék na covid-19
Dnes je remdesivir jediným léčivým přípravkem povoleným v EU k léčbě pacientů s onemocněním covid-19. Podle doporučení evropské lékové agentury EMA mohou lékaři remdesivir použít k léčbě pacientů s covid-19 starších 12 let s pneumonií. Tedy zápalem plic, jejichž zdravotní stav vyžaduje doplňkovou léčbu kyslíkem.
EK rozhodla o podmíněné registraci remdesiviru na doporučení lékové agentury EMA letos v červnu. Své rozhodnutí odůvodnila EMA slovy, že přínosy léčby u pacientů s těžkým průběhem covidu-19, kteří vyžadují doplňkovou léčbu kyslíkem, převažují nad jejími riziky.
Remdesivir se podává nitrožilní infuzí a předepisují ho pouze vybraná zdravotnická zařízení, kde se pacienti podrobněji sledují. Konkrétně před zahájením léčby a v jejím průběhu lékaři sledují funkce jater a ledvin. Počáteční dávka je 200 mg první den, následuje jedna infuze 100 mg denně. Celková délka léčby by měla být nejméně 5 dnů, ale ne delší než 10 dní.
Martin Balík ze VFN má s remdesivirem dobré zkušenosti
Vedoucí lékař Kliniky anestezie, resuscitace a intenzivní medicíny Všeobecné fakultní nemocnice [VFN] Martin Balík v polovině října uvedl, že remdesivir ochránil mnoho pacientů před nutností intenzivní péče. K výsledkům dřívějších klinických testů WHO, které vliv léku na délku hospitalizace či přežití popíraly, se Balík tehdy podrobněji vyjadřovat nechtěl.
„Naše zkušenosti jsou ale takové, že při dodržení specifických indikačních podmínek lék funguje. Dokonce jsem přesvědčený, že mnoho pacientů ochránil před přechodem na intenzivní péči,“ řekl k remdesiviru.
500 milionů dávek remdesiviru pro Evropu
Na začátku října podepsala Evropská komise [EK] s americkou firmou Gilead Sciences, jež remdesivir vlastní, kontrakt na dodávku půl milionu jeho dávek. Lék EK přerozdělí podle dohody mezi unijní, ale i mimounijní země.
Zmíněnou dohodu podepsalo 34 zemí EU, Evropského hospodářského prostoru [EHP] a Spojeného království. Ve smlouvě figurují i čtyři kandidátské země a potenciální kandidáti na členství v EU. Tedy Albánie, Republika Severní Makedonie, Černá Hora a Bosna a Hercegovina.
–ČTK/RED–