Léčivý přípravek Zolgensma na léčbu spinální svalové atrofie obdržel od Evropské komise [EK] podmíněnou registraci. Ačkoliv se tím jeho dostupnost v Česku zvyšuje, neznamená to, že bude dostupný pro všechny pacienty.
Lék Zolgensma je schválen k léčbě pacientů s 5q spinální muskulární atrofií [SMA)] s bialelickou mutací genu SMN1 a klinicky stanovenou SMA 1. typu, nebo pacientů s 5q SMA s bialelickou mutací genu SMN1 a až 3 kopiemi genu SMN2.
„To, kdy a kam jej začne držitel rozhodnutí o registraci dodávat, je čistě na jeho rozhodnutí. Státní ústav pro kontrolu léčiv obecně na taková obchodní rozhodnutí soukromých subjektů nemá žádný vliv. Je ale pravda, že pro další české pacienty se tímto rozhodnutím stává přípravek Zolgensma dostupnější, než tomu bylo doposud,“ vysvětluje ředitelka Státního ústavu pro kontrolu léčiv [SÚKL] Irena Storová.
Spinální svalová atrofie [SMA – spinal muscular atrophy] je vzácné geneticky podmíněné onemocnění, které způsobuje svalovou slabost. Nemocní mají potíže s dýcháním, polykáním a postupně ztrácejí schopnost pohybu. Později jsou plně odkázaní na invalidní vozík a pomoc druhých. V Česku bylo podání léku Zolgensma doposud schváleno pro tři malé pacienty, jeden z nich už svůj lék dostal minulý týden. Výsledky léčebné terapie by měly být známy do tří měsíců. Dalším dvěma by měl být podán v nejbližších týdnech. Podání léku Zolgensma bylo podmíněno vydáním souhlasného stanoviska od Ministerstva zdravotnictví ČR [MZ ČR].
Podmíněná registrace se vydává na jeden rok
Podmínečná registrace [CMA – Conditional Marketing Authorisation] může být udělena tehdy, pokud u léčivého přípravku převažují jeho přínosy nad riziky a je žádoucí, aby byl léčivý přípravek dostupný na trhu. Zároveň se musí jednat o lék k léčbě onemocnění, pro která není dostupná jiná alternativa. Rovněž musí být splněn předpoklad, že žadatel je schopen předložit nejpozději do 1 roku chybějící data. Podmínečná registrace je totiž platná právě 1 rok a až při předložení dodatečných dat může být taková registrace případně prodloužena. V případě léčivého přípravku Zolgensma musí držitel rozhodnutí o registraci předložit data konkrétně ze tří studií. Termíny a další podrobnosti jsou uvedeny v části E, přílohy II k rozhodnutí Komise.
„Dle souhrnu údajů o přípravku není lék kontraindikován pro použití u dětí starších dvou let. S léčbou pacientů starších dvou let nebo s hmotností nad 13,5 kilogramu jsou jen omezené zkušenosti,“ vysvětluje Irena Storová s tím, že bezpečnost a účinnost tohoto přípravku u takových pacientů nebyla dosud stanovena.
Zolgensma dává šanci na trvalé uzdravení
Lék Zolgensma je světově prvním lékem systémové genové léčby v medicíně. Ta u registrovaných léků doposud spočívala v úpravě buněk mimo tělo pacienta či v lokálním podání. V tomto případě se virový vektor podává pacientům formou infuze a dostává se do všech buněk těla. Jde o první lék, který je při systémovém podání schopen jednorázově vyřešit genetický deficit pacienta. Jednou infuzí se opraví určitá genetická porucha. A to dle dostupných dat dokonce jednou provždy. Podle odborníků se jedná o přelomovou terapii.
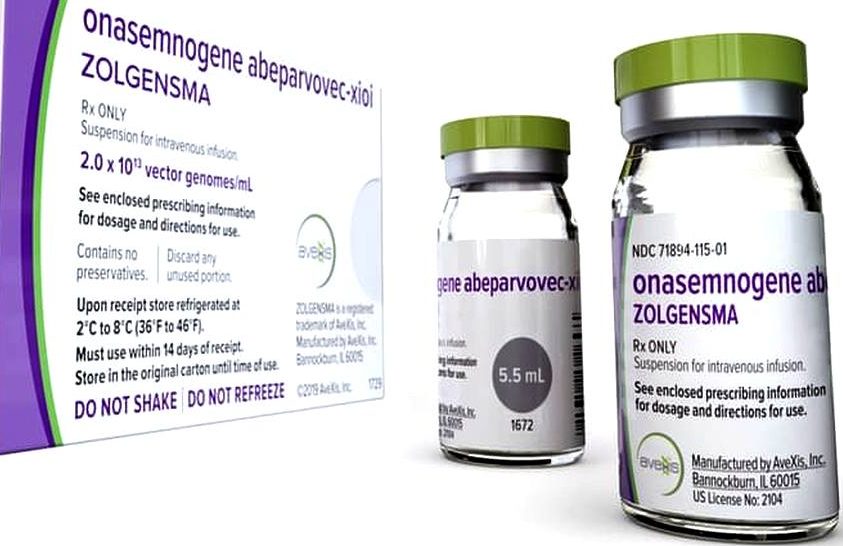
Zolgensma je obchodní název léku. Léčivou látkou této genové terapie je onasemnogen abeparvovec. Její název vychází ze schématu názvosloví pro léčivé přípravky pro moderní terapii, kam genová terapie spadá. Některé předpony jsou voleny volněji tak, aby se odlišily jednotlivé léčivé látky mezi sebou. Některé jsou naopak vázány pravidly [-gene, -parvo, -vec].
Konkrétně u tohoto léčivého přípravku indikuje jeho název následující:
Ona znamená, že se jedná o 1 gen, tj. z anglického „one“.
Semno je modifikací zkratky pro SMN [Survival of Motor Neuron 2 gene].
Přípona gene označuje, že se jedná o gen.
Abe je tzv. promotor genu [Chicken Actin Beta, resp. Chicken Beta Actin, CBA].
Parvo je přípona označující adeno-asociovaný virus [AAV].
Vec je přípona označující nereplikující se virový vektor.
–VRN–